Varias de las entradas anteriores (ver aquí y aquí, por ejemplo) las hemos dedicado a explicar cómo el intento por entender ciertos fenómenos naturales condujeron a los físicos y matemáticos de principios del siglo XX a proponer algunas teorías poco ortodoxas. En esta entrada vamos a contar la historia del descubrimiento de la estructura atómica y, cómo no, del papel que tuvieron las matemáticas en dicho descubrimiento.

A finales del siglo XIX no estaba claro cómo estaba constituida la materia. Si bien la mayoría de los científicos no dudaban que la materia estaba compuesta por átomos, ninguno de ellos tenía la menor idea de cómo eran dichos átomos. El ejemplo más representativo de lo que se sabía acerca del tema está muy bien descrito en el discurso que pronunció el eminente químico y físico inglés William Crookes en el Congreso de la British Association for the Advancement of Science en 1898:
¿Qué es el átomo? ¿Es el mismo átomo el que aparece en los estados sólido, líquido o gaseoso? Cada uno de estos estados involucra ideas que tienen que ver solamente con vastas agrupaciones de átomos. Si, como Newton, intentamos visualizar a un átomo como un cuerpo duro, esférico, o, como Boscovitch y Faraday, considerarlo como un centro de fuerza, o aceptar la teoría atómica vorticial de lord Kelvin, un átomo aislado es una entidad desconocida difícil de concebir.
La afirmación de Crookes es profunda pues efectivamente el átomo es demasiado pequeño para verlo, pero todo está compuesto de millones y millones de estos diminutos ladrillos. En esta entrada vamos a contar como se gestó el primer modelo atómico “moderno”, el conocido modelo “planetario” hoy aceptado por todos y que fue propuesto por el neozelandés afincado en Inglaterra Ernest Rutherford. Comencemos pues nuestra historia.

Si bien los primeros modelos atómicos se remontan a los griegos, nosotros comenzaremos unos cuantos siglos más adelante con el modelo del pastel de pasas de J.J. Thomson, quien propuso un modelo más o menos razonable y que podía explicar cuantitativamente algunos de los resultados experimentales del momento, a saber: las dimensiones reales de los átomos y que en el interior de estos debía haber partículas pequeñas que portaban cargas (los que luego se denominarían electrones, algo que el propio Thomson confirmaría en un clásico experimento con rayos catódicos). La mejor descripción del modelo de J.J. Thomson apareció en un libro titulado “Electricity and Matter” publicado en 1904 que escribió el propio Thomson y donde plasmó todas sus ideas sobre el tema.

En la página 96 del capítulo V de dicho libro, J.J. describe su modelo del pastel de pasas que establecía que el átomo estaba constituido por una esfera cargada positivamente dentro de la cual se encontraban los electrones (que todavía llamaba corpúsculos). La cantidad de carga positiva total debía ser igual a la suma de las cargas de los electrones (pues el átomo era eléctricamente neutro). Veamos qué predicciones nos podía dar dicho modelo. Supongamos por simplicidad que tenemos un átomo de hidrógeno, y asumamos, tal y como se asumía en aquella época, que la oscilación del electrón dentro del átomo era la responsable de la emisión de ondas electromagnéticas con una longitud de onda determinada. Entonces, suponiendo que la esfera positiva tiene radio R, las leyes de Newton en combinación con la electrodinámica de Maxwell nos permiten calcular la frecuencia de dicha radiación:
$$
\omega^2=\frac{e^2}{mR^3},
$$
donde \(e\) es la carga del electrón y \(m\) su masa. Si tomamos la frecuencia \(\omega\) igual a \(6\cdot 10^{-7}m\), correspondiente al espectro visible del hidrógeno, obtenemos una estimación del radio del átomo de \(3\cdot 10^{-10}m\) en perfecta concordancia con los experimentos de la teoría de los gases entre otros. Pero … ¿cómo mantener en equilibrio dicho sistema? Por un lado los electrones se repelen entre ellos y por el otro son atraídos por el campo generado por la esfera positiva. En otras palabras, el modelo tenía un gran problema con las estabilidad y, aunque J.J. Thomson intentó usar dicho defecto para dar una explicación al fenómeno de la radioactividad (en el capítulo VI de su libro) al final el modelo fue descartado pues fue superado por un modelo más simple: el modelo “planetario” de Ernest Rutherford. He aquí su historia.

Corría el año 1895 cuando un recién graduado estudiante de física neozelandés de 24 años llamado Ernest Rutherford llega a Cambridge tras conseguir una beca para continuar sus estudios en Inglaterra. El sitio elegido por el joven Rutherford fue precisamente el laboratorio Cavendish que dirigía en aquel momento el mismísimo J.J. Thomson y que era uno de los laboratorios mejor equipados de Inglaterra. En Cambridge Rutherford llevó a cabo sus primeras investigaciones y publicó varios artículos que le granjearon el respecto de los físicos del momento. Tal fue así que con solo 27 años, en 1898, le fue ofrecida una cátedra en la Universidad de Montreal, puesto que aceptó. En Montreal se dedicó al estudio de la radioactividad obteniendo unos resultados tremendamente importantes. Por un lado Rutherford se da cuenta de que la radiación emitida por el uranio (y en general por los elementos radioactivos, la recién descubierta radioactividad de Becquerel) está compuesta por tres tipos muy distintos: las que hoy conocemos como radiación alfa, beta y gamma. Por otro lado descubre junto a su colega Frederick Soddy (un químico inglés que trabajó durante varios años en Montreal) que la radiactividad viene acompañada de una desintegración de los elementos, algo completamente novedoso pues en aquella época se creía que la materia era indestructible. En esa misma época también Rutherford deduce la famosa fórmula de la descomposición radioactiva que publica junto con Soddy en 1902-1903. Las investigaciones que llevó a cabo en Montreal le proporcionaron el Premio Nobel de Química «por sus investigaciones en la desintegración de los elementos y en la química de las sustancias radioactivas» lo cual no deja de tener cierta gracia ya que Rutherford se consideraba un físico y se le atribuye la frase «All Science is Either Physics or Stamp Collecting» («toda la ciencia es física o filatelia») (véase a ese respecto un interesante artículo pinchando aquí)
Poco antes de recibir el premio, en 1907, Rutherford deja Montreal para regresar a Inglaterra y hacerse cargo del Laboratorio de Física de Manchester, otro de los mejores laboratorios del mundo. Fue allí donde se consumó la visión de modelo atómico que aceptamos hoy en día. Por esa época Rutherford estaba interesado en el proceso de difusión de las partículas alfa (las que ya mencionamos antes y que no son más que iones de helio), problema que consistía en estudiar como se difundían las partículas alfa al pasar por distintos medios, en particular a través de láminas muy finas de distintos metales. Estos últimos experimentos los estaba realizando el entonces ayudante de Rutherford, Hans Geiger (el mismo del famoso contador Geiger) junto a Ernest Marsden, que en aquella época era un estudiante sin graduarse (estaba cursando el último año de su carrera) en el laboratorio de Rutherford. Los resultados que estaban obteniendo eran bastante “raros”, incluso llegaron a pensar que no tenían sentido pues lo que esperaban era que al traspasar la lámina de metal la trayectoria de las partículas alfa variara unos pocos grados, y habían visto que algunas veces la difusión casi alcanzaba los 90 grados.la razón fundamental era que según el modelo del pudín de pasas la desviación de las partículas alfa tendría que ser muy pequeña como se aprecia en la siguiente figura:
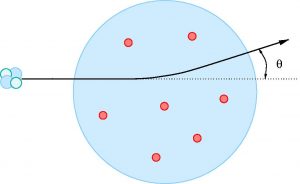

Rutherford, que habitualmente visitaba el laboratorio y se interesaba por el estado de los experimentos, entró en el laboratorio y Marsden le explicó la situación. Dejemos que sea el propio Marsden quien lo cuente:
Rutherford había estado pensando sobre el asunto, se volvió hacia mi y me dijo “Mire si puede obtener algún efecto de las partículas alfa directamente reflejadas por una superficie metálica”. No creo que esperase que se produjese ningún resultado, pero fue una de esas corazonadas de que tal vez se pudiese observar algún efecto … Rutherford estuvo siempre dispuesto a enfrentarse con lo inesperado y explotarlo, si fuese posible, aunque también sabía cuando detener tales exploraciones. Naturalmente, yo sabía lo suficiente para darme cuenta de que, incluso aunque lo que se esperase fuese un resultado negativo, si dejaba escapar algún resultado positivo cometería un pecado imperdonable. […] Para mi sorpresa, fui capaz de observar el efecto que buscaba […] Recuerdo bien cuando informé a Rutherford del resultado una semana más tarde […] Unas pocas semanas más tarde Rutherford me dio instrucciones para que preparase los resultados del experimento con Geiger en una forma adecuada para su publicación. [tomado del artículo de Marsden en «Rutherford at Manchester«, J.B. Birk ed., W.A. Benjamin, 1963]
Una historia parecida (escencialmente era la misma, solo que difería en pequeños detalles) la contó el propio Rutherford años más tarde (en 1936) en una conferencia titulada «Forty Years of Physics» (publicada en el libro Background To Modern Science, J. Needham, Joseph y W. Pagel, eds. Cambridge University Press, 1938). En la página 68 Rutherford recordaba cuando Geiger le contó que había partículas alfa que se dispersaban hacia atrás:
Fue el evento más increíble que me ha sucedido en mi vida. Fue casi tan increíble como si dispararas un proyectil de 15 pulgadas contra un trozo de papel de seda y volviera y te golpeara. En consideración, me di cuenta de que esta dispersión hacia atrás tenía que ser el resultado de una sola colisión, y cuando hice los cálculos vi que era imposible obtener algo de ese orden de magnitud a menos que tomaras un sistema en el que la mayor parte de la masa del átomo se concentrara un diminuto núcleo. Fue entonces cuando tuve la idea de un átomo con un centro masivo diminuto cargado.
Así, el 19 de mayo de 1909, la Royal Society recibió el manuscrito «On a Diffuse Reflection of the α-Particles» firmado únicamente por Geiger y Marsden, todo un ejemplo de honestidad y generosidad por parte de su jefe y tutor Rutherford quien no firmó dicha importante contribución. ¿Por qué ese experimento fue tan importante? La razón es simple: ese experimento descartaba el modelo del pastel de pasas pues usando dicho modelo era imposible conseguir explicar cómo una partícula alfa al ser disparada contra una lámina de metal rebotaba con un ángulo mayor de 90º.

Así que Rutherford comenzó a darle vueltas al asunto, algo que le costó dos años, aparentemente una eternidad según el punto de vista de muchos (si lo medimos con los baremos de hoy en día), pero como muy bien explica Sánchez-Ron en su libro “Historia de la Física Cuántica” las consecuencias del experimento de Geiger y Marsden no eran tan obvias como se puedan pensar: había que asegurarse de que las matemáticas del átomo de J.J. Thomson no funcionaban, es decir, que no podían explicar semejante desviación de la trayectoria, y no solo, había también que probar que el nuevo modelo sí que lo conseguía. Eso fue lo que consiguió Rutherford en su artículo publicado en mayo de 1911 en el Philosophical Magazine (aunque los resultados los había presentado en la Manchester Literary and Philosophical Society en febrero del mismo año). Al comienzo de ese trabajo Rutherford escribía:
Generalmente se ha supuesto que la difusión que sufre un haz de rayos alfa o beta al pasar por una lámina delgada de materia es el resultado de una multitud de pequeñas difusiones por los átomos de la materia atravesada. Sin embargo, las observaciones de Geiger y Marsden sobre la difusión de rayos alfa indican que algunas de las partículas alfa deben sufrir una desviación mayor que un angulo recto en un solo encuentro […] Un sencillo cálculo basado en la teoría de las probabilidades demuestra que la posibilidad de que una partícula alfa sea desviada más de 90º es infinitamente pequeña.
Tras ello Rutherford mostraba que si usaba el modelo de J.J. Thomsom era imposible que en un único encuentro (hay que hacer notar que Rutherford evitaba usar la palabra choque, por ser esta exclusiva de la mecánica y no de las interacción del campo eléctrico que era lo que, incluido él mismo, se pensaba) la partícula alfa rebotase hacia atrás como se veía en el experimento.

¿Qué propuso Rutherford? Pues que el átomo estaba constituido por un núcleo concentrado en unos \(10^{-12}\) cm rodeado por una esfera de electrones de radio \(10^{-8}\) cm. Para demostrar la idoneidad de su modelo Rutherford dedujo una fórmula que relacionaba la fracción del número total de partículas que son desviadas con un ángulo mayor que \(\theta\), algo que en principio se debería poder medir experimentalmente. Lo que ocurrió a continuación nos lo cuenta su, entonces ayudante, Hans Geiger:
Un día (de 1911) Rutherford, evidentemente en el mejor de su ánimo, vino a mi habitación y me dijo que ahora sabía cómo era el átomo y cómo explicar las grandes desviaciones de las partículas alfa. Aquel mismo día comencé a comprobar la relación que Rutherford esperaba que existiese entre el número de partículas difundidas y el ángulo de la difusión.
El 11 de abril de 1911, apenas un mes después de presentar su modelo en la Manchester Literary and Philosophical Society, Rutherford escribía a su colega Bertram Borden Boltwood que Geiger y Marsden estaban trabajando para comprobar la veracidad de sus fórmulas, algo que lograron dos años más tarde, en 1913. Así pues, todo parecía indicar que se desvelaban los primeros secretos del átomo, pero…
Sí, amigo lector, otro de esos “odiosos” peros. Ya mencionamos antes que uno de los grandes inconvenientes teóricos del modelo de J.J. Thompson era la estabilidad. Pues bien, toda la física sobre la que se basaba el modelo de Rutherford era la física clásica de Newton (mecánica) y Maxwell (electromagnetismo), y era bien sabido que dichas teorías predecían que una carga eléctrica en movimiento acelerado, como el electrón en el modelo de Rutherford, debía radiar energía y por tanto moverse en una órbita que terminaría cayendo al núcleo, algo que además ocurría en un tiempo récord del orden de \(10^{-10}\) segundos. Otra vez las matemáticas, esa parte imprescindible del método científico, echaban por tierra las esperanzas de los físicos por descifrar el misterio de la estructura atómica. Curiosamente el propio Rutherford era consciente de este problema y él mismo echaba balones fuera en relación con esta cuestión al final de su trabajo de 1911:
La cuestión de la estabilidad del átomo propuesto no necesita ser considerada en este momento, ya que esto obviamente dependerá de la estructura interna del átomo y del movimiento de las partes cargadas constituyentes.
Uno no puede más que sonreír leyendo esto. Pero hay que perdonar al bueno de Ernest pues para entender el átomo, y todo ese mundo microscópico, se necesitaba de una nueva Física pues con la Física clásica era imposible de responder a este tipo de preguntas. Ya lo vimos en el caso de la radiación de un cuerpo negro, y no iba a ser diferente en este caso. Se iba a necesitar de la reciente física cuántica de Planck, Einstein y demás. Pero eso ya lo contaremos en próximas entradas.
Para saber más:
José Manuel Sánchez Ron, Historia de la física cuántica: I. El período fundacional (1860-1926), Drakontos, 2001.
Más sobre la vida y obra de Rutherford lo puedes encontrar en la web: https://history.aip.org/history/exhibits/rutherford/

Dejar una contestacion