La estructura atómica y el problema de los espectros.
Era un hecho aceptado en 1913 que el átomo estaba constituido por un núcleo «pesado» y «denso» que contenía toda la materia del átomo y electrones girando a su alrededor. Este modelo, una especie de sistema solar en miniatura, sencillo y funcional, fue propuesto por Ernest Rutherford a partir de los resultados de experimentos de dispersión que realizaron Geiger y Marsden a principios de 1909 y que publicaron en mayo de ese mismo año como ya contamos en nuestra entrada anterior.
Como comentamos allí, ese modelo era capaz de explicar las discrepancias observadas al bombardear átomos de oro con partículas alfa (núcleos de helio), pero tenía un «pequeño» problema: como toda carga en movimiento acelerado emite ondas electromagnéticas, los electrones que giraban alrededor del núcleo debían perder energía y caer al núcleo –además en un tiempo récord: \(10^{-11}\) segundos–. Por tanto, tenía que existir alguna explicación que la mecánica y electrodinámica clásicas no eran capaces de dar. Así pues, los físicos de principio del siglo XX tenían en su lista de problemas entender cómo podían los electrones mantenerse en sus órbitas sin caer al núcleo.
Pero esta era una de las partes del problema. Había otra cuestión muy interesante que además tiene que ver con otro de los temas que ya hemos tratado en este blog: ¿cómo irradian energía los cuerpos? Ya vimos aquí que al calentar un cuerpo, este emite energía en todo el espectro electromagnético. Pero a lo largo del siglo XIX se descubrió otro hecho sorprendente: si se observa la luz que pasa a través de ciertos elementos químicos en estado gaseoso se ven ciertas franjas negras muy finas (conocidas como líneas de absorción) en el espectro (visible) de los mismos, es decir, como si faltaran ciertas frecuencias (o longitudes de onda). Algo similar ocurría al excitar dichos elementos y observar la luz que desprendían: aparecían ciertas líneas brillantes (líneas de emisión) en determinadas longitudes de onda, justo en la misma posición donde se encontraban las lineas de absorción.
En la siguiente figura vemos la zona visible del espectro electromagnético que corresponde a la franja de longitudes de onda entre 380 u 750 nanómetros (\(10^{-9}\) metros), así como las lineas de emisión y absorción del hidrógeno:

Estos resultados espectrales habían sido establecidos por un nutrido grupo de físicos a lo largo del siglo XIX que se dedicaban a lo que hoy conocemos como espectrografía y entre los que destacaron, entre otros, Fraunhofer, Foucault, Ångström, Kirchhoff y Bunsen. Más aún, era un hecho bien conocido que para cada elemento químico había una única secuencia de dichas líneas (tanto de absorción como de emisión), algo que no tenía ninguna explicación teórica satisfactoria pues precisaba de una nueva física todavía por llegar. Que cada elemento tiene una única secuencia de lineas espectrales es un principio básico de la espectroscopía y es lo que ha permitido, entre otras cosas, saber la composición química de las estrellas, que de otra forma sería imposible de determinar. En otras palabras, el espectro de emisión o absorción de una sustancia es como un DNI o huella «digital» de la misma.
Un caso especialmente llamativo en su momento fue una fórmula matemática que describía el espectro del hidrógeno. Dicho descubrimiento fue hecho por un maestro de escuela suizo aficionado a la espectrometría llamado Johann J. Balmer (aunque maestro de escuela Balmer había estudiado matemáticas en Karlsruhe y Berlín, y defendido su tesis doctoral en la Universidad de Basilea, Suiza). Balmer, repasando los datos experimentales, descubrió en 1885 que las líneas espectrales del hidrógeno en el espectro visible venían dadas por una fórmula muy curiosa
$$
\lambda=\frac{m^2}{m^2-4}\, 3645\cdot 10^{-10}\, \mbox{m}
$$
que obtuvo comparando los resultados experimentales de varios espectroscopistas. Mehra cuenta en su libro [1] la historia de como Balmer dio con la fórmula. La historia es cuanto menos curiosa. G. P. Thomson (el hijo de J. J. Thomson, el del modelo atómico del pudín de pasas del que ya hablamos en otra entrada) cuenta que durante una visita a Suiza tras la segunda guerra mundial un pariente de Balmer (Balmer murió en 1898) le contó que este (Balmer) era un devoto de la numerología, que le gustaba saber cuantas ovejas había en un rebaño, cuantos escalones en las pirámides, etc. Así que un día charlando con un amigo físico, este le sugirió que descubriera qué había detrás de la secuencia de números del espectro del hidrógeno, algo que Balmer consiguió y publicó en 1885.
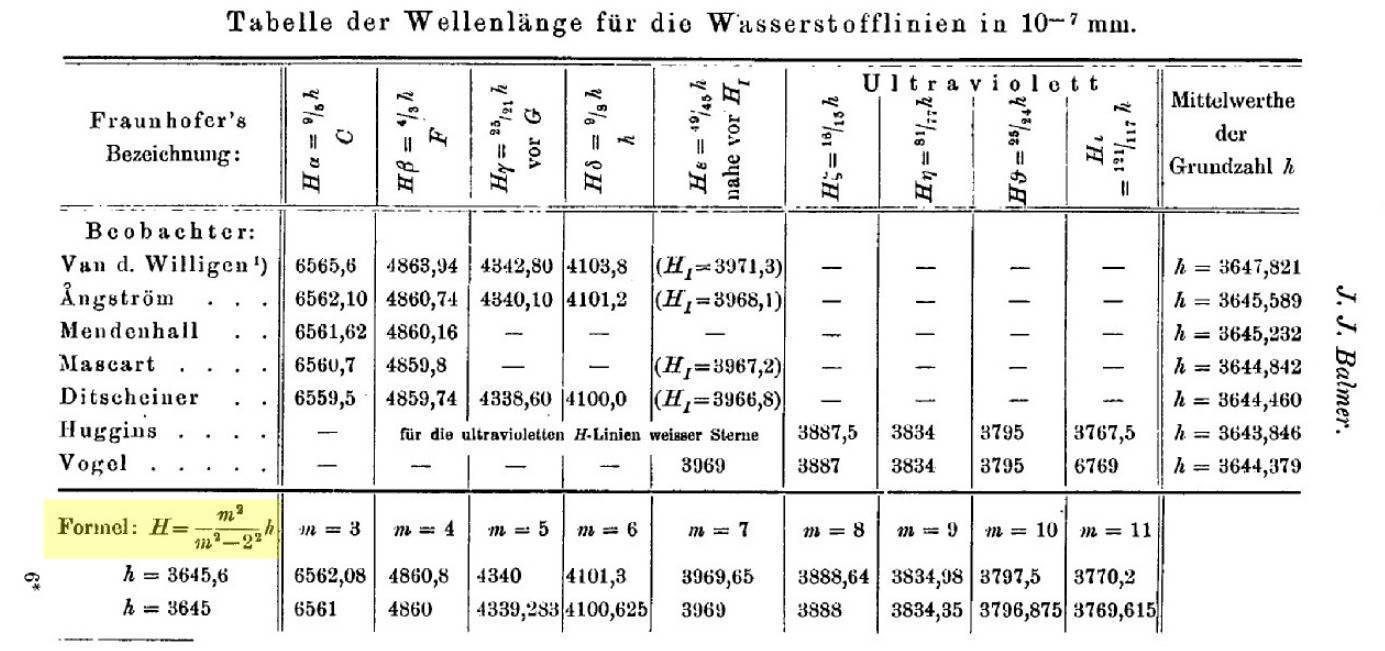
Para lo que sigue conviene reescribir la fórmula de Balmer de la siguiente forma equivalente
$$
\frac1{\lambda}= R_H\left(\frac{1}{m^2}-\frac{1}{n^2}\right),\qquad m=2,\,\, n=3,4,\dots\,,
$$
donde \(R_H\) es la constante de Rydberg cuyo valor es \(\approx 1.09\times 10^7 \,\mbox{metros}^{-1}\), bautizada en honor al espectroscopista sueco Johannes Rydberg.
Una de las cosas que más llamó la atención de Balmer, y luego también de otros muchos físicos, incluido Rydberg, era la aparición de números enteros en la fórmula para describir el espectro del hidrógeno. Lo curioso de la historia era que Rydberg había estado buscando una fórmula similar pero que describiera el espectro de todos los elementos químicos y no solo el hidrógeno. Cuando Rydberg leyó el trabajo de Balmer se convenció que la expresión tenía que ser del tipo
$$
\frac1{\lambda}= \frac{K}{(m+\mu)^2}-\frac{K}{(n+\nu)^2} ,\qquad n>m=1,2,3,4,\dots\,,
$$
donde \(K\) era cierta constante universal y \(\mu\), \(\nu\) ciertos números reales (que podían depender del elemento en cuestión). Si comparamos la fórmula anterior con la fórmula de Balmer vemos que \(m=2\), \(K=R_H\) y, para el caso del hidrógeno, ha de ser \(\mu=\nu=0\). Por ejemplo, dicha fórmula explicaba perfectamente las series espectrales del hidrógeno en todo el espectro electromagnético y no solo en la parte visible. El pormenorizado estudio de Rydberg fue publicado en 1890 y constaba de 150 páginas.
Un danés en la corte del Rey Arturo
Tras este amplio preámbulo, ya estamos en condiciones de responder a la pregunta inicial de ¿cómo podían los electrones mantenerse en sus órbitas sin caer al núcleo? y de paso explicar cómo es posible que aparecieran esos números enteros en el espectro de los elementos químicos. Quien logró resolver dicho enigma fue un joven físico danés de visita en Inglaterra y su historia es representativa de ese dicho popular de «estar en el momento justo y en el lugar adecuado».
Niels Bohr nació en Copenhague en 1885. Su padre era profesor de Fisiología de la Universidad y su madre era hija de un banquero y político judío. Desde pequeño en su casa reinaba un ambiente intelectual muy propicio, lo que seguramente influyó en que su hermana mayor Jenny estudiara historia e inglés y se dedicara a dar clases toda su vida, y su hermano pequeño, Harald se convirtiera en un reconocido matemático (que se doctoró incluso antes que el propio Niels), aparte de un magnífico delantero que jugó incluso en la selección nacional danesa de fútbol (cuentan que a la defensa de su tesis doctoral fueron más aficiondos de fútbol que científicos). Niels estudió en la Universidad de Copenhague Física, Matemática y Filosofía, decantándose por la Física en 1909 y doctorándose en 1911. Tras defender su doctorado con una tesis sobre la teoría electrónica de los metales, consiguió una beca de la Fundación Carlsberg (sí, la de la famosa cerveza danesa) que le permitió incorporarse en septiembre de 1911 nada menos que al Laboratorio Cavendish en Cambridge dirigido por el mismísimo J. J. Thomson, el descubridor del electrón y el que propuso el modelo atómico del pudín de pasas del que hablamos en la entrada anterior. La esperanza de Bohr era discutir con Thomson su teoría sobre los metales pero pronto descubrió que J. J. era un hombre muy atareado y difícil de abordar y así se lo contó a su hermano Harald, con quien mantenía una abundante correspondencia. Pero entonces ocurrió el milagro. (O ese suceso improbable…)
Durante una visita de Bohr a un amigo de su padre en Mánchester, este le presentó a Rutherford y Bohr vio la oportunidad de aprender algo de radioactividad. Así que a mediados de marzo de 1912 se trasladó al laboratorio de Rutherford en Mánchester justo en el momento que Geiger y Marsden estaban realizando los experimentos que confirmaban el modelo atómico de Rutherford. No se podía estar en mejor lugar ni en mejor momento si se quería estar al tanto de los últimos avances en la teoría atómica. Así que Bohr, a quien le interesaban mucho más los aspectos teóricos que los experimentales, se puso a ello. Al parecer el primer esbozo del que sería el primero de sus tres artículos fundamentales (que a la postre le valieron el premio Nobel de 1922 for his services in the investigation of the structure of atoms and of the radiation emanating from them (por sus servicios en la investigación de la estructura de los átomos y de la radiación que emana de ellos) tuvo lugar en el verano de 1912. De sus cartas a Harald se deduce que en junio de 1912 Bohr estaba enfrascado en el estudio de la estructura atómica y que el 19 de junio ya tenía algunas ideas prometedoras tal y como le escribió a su hermano:
Puede ser que quizás haya descubierto alguna pequeña cosa sobre la estructura de los átomos. No debes decirle a nadie nada al respecto; de lo contrario, no podría escribirte sobre esto tan pronto. Si estoy en lo cierto, no sería una indicación con naturaleza de posibilidad, sino quizás una pequeña parte de la realidad.
¿Qué fue lo que encontró Bohr? Con absoluta certeza no se sabe pero con un margen muy pequeño de error se ha podido reproducir a partir de los manuscritos de Niels y su correspondencia (principalmente con su hermano Harald) lo que ocurrió, pero lo que sí es seguro es que el 6 de julio de 1912 le escribió a Rutherford un informe detallado, hoy día conocido como el Memorandum de Rutherford, de sus investigaciones teóricas sobre el átomo donde explicaba sus hipótesis y sus propuestas. En primer lugar, Bohr afirmaba que era imposible que existiese una configuración de equilibrio en el átomo sin movimiento de electrones y por tanto estos habrían de girar alrededor del núcleo. Pero entonces, como ya hemos dicho, hay un problema con la estabilidad (el sistema es mecánicamente inestable, los electrones han de caer al núcleo). Para resolver este problema Borh afirmaba que había que usar alguna hipótesis más allá de la mecánica clásica y se decantaba por una hipótesis «cuántica» a lo Planck y Einstein: que la energía cinética de los electrones en las órbitas estables es proporcional (con una constante de proporcionalidad fija) al tiempo de rotación del electrón (o a su frecuencia si se prefiere).
Bohr regresó a Copenhague el 24 de julio tras terminar su año postdoctoral y contrajo matrimonio el 1 de agosto con Margrethe Nørlund, con quien llevaba prometido desde hacia varios años.

Tras el viaje de novios, Bohr se incorporó a la Universidad de Copenhagen y prosiguió sus investigaciones. Fue en ese momento cuando conoció el trabajo de J. W. Nicholson sobre los espectros de nebulosas y de la corona solar. En uno de sus trabajos Nicholson introducía una hipótesis cuanto menos extraña: que el momento angular del sistema fuese igual a un múltiplo entero de la constante de Planck \(\hbar\). No se sabe la razón por la cual Nicholson lo hizo, pero resultó más que provechosa en manos de Bohr, como veremos más adelante.
Ya Bohr tenía todo lo necesario para desarrollar su modelo atómico, algo que hizo, y el 6 de marzo de 1913 le escribió a Rutherford una carta que contenía el primero de sus tres artículos para enviarlo a Philosophical Magazine. Ese artículo lo haría famoso en el mundo entero.

Tras su estancia en Mánchester, Bohr fue contratado como docente en la Universidad pero apenas tenía tiempo y dinero para poder proseguir con sus investigaciones teóricas y no tenía acceso (al no haberlo) a ningún laboratorio de física en Copenhague. Así que en marzo de 1914 comenzó a presionar a la Universidad y al Ministerio de Educación, para lo cual pidió ayuda a Rutherford, que le respaldó en una carta escrita el 16 de marzo de 1914 en la que escribía:
He tenido la mejor de las oportunidades de formarme una opinión definitiva de sus habilidades […]. Personalmente creo firmemente que sus teorías muestran una gran originalidad y mérito […]. En mi opinión el Dr. Bohr es uno de los más prometedores y capaces de los jóvenes físico-matemáticos de Europa hoy día.
Eso, junto al apoyo de parte del profesorado de la Facultad de Física y Matemáticas, hizo que el 21 de abril la Universidad decidiera abrir una plaza de profesor de física teórica, la primera en dicha universidad, aunque la burocracia podía tardar un tiempo. Pero entonces Niels recibió una oferta de esas que no se pueden rechazar: una plaza como lector (profesor auxiliar) en Mánchester a propuesta de Rutherford. Tras dos años en Mánchester con Rutherford, Bohr regresó definitivamente a Copenhague en 1916 y obtuvo su ansiada cátedra, puesto en el que se mantuvo renunciando incluso a una plaza de profesor en Mánchester por parte de Rutherford con unas condiciones inimaginables para Bohr en Dinamarca. Pero Bohr se sentía en deuda con su país de origen y quería formar en Copenhague una escuela de física teórica, una escuela similar a la que había visto en Mánchester y que luego pasaría a la historia de la física. Pero Bohr no solo consiguió una cátedra, sino también todo un instituto: por primera vez la Universidad de Copenhague iba a tener un instituto de física teórica.
Bohr dedicó el resto de su vida a su instituto, a excepción de un obscuro periodo comprendido entre el 29 de septiembre de 1943 y el 25 de agosto de 1945. La razón fue, como habrá adivinado el lector, la anexión de Dinamarca por los nazis en 1940, y más aún tras la orden directa de Hitler el 28 de septiembre de 1943 de deportar a todos los judíos daneses para su exterminio. Los Bohr, y otros muchos judíos, se enteraron de ello (la historia está magníficamente contada en el libro [3] sobre la vida y obra de Bohr, escrito por quien fuera su asistente Abraham Pais, que también fue biógrafo de Einstein) y tuvieron que huir. El 29 de septiembre Bohr huyó a Suecia en un bote y de ahí viajó a Inglaterra y a los Estados Unidos, donde participó en el proyecto Manhattan para la construcción de la bomba atómica. Tras la guerra, Bohr regresó a Copenhague, donde vivió hasta su muerte el 8 de noviembre de 1962.
Si el legado científico de Bohr fue enorme, su entereza personal no lo fue menos pues, por ejemplo, entre 1939 y 1943 ayudó a miles de judíos (y no solo científicos) a huir de una muerte segura a manos de los nazis. Tras la guerra, además, se convirtió en defensor del desarme nuclear e incluso escribió una carta abierta a las Naciones Unidas en 1950 abogando por la cooperación internacional sobre la energía nuclear que no excluyera a la Unión Soviética (su simpatía por la URSS casi le cuesta la cárcel en 1944 cuando residía en Reino Unido).
Sobre su obra se han escrito libros y hasta una obra de teatro Copenhagen escrita por el dramaturgo inglés Michael Frayn y que fue llevada al cine (para la TV) en el 2002, que especula sobre el encuentro entre Bohr y Heisenberg en 1941 y lo que allí ocurrió.
Ya es momento de que discutamos las matemáticas del primer modelo cuántico del átomo.
Las matemáticas del modelo de Bohr
Veamos como Niels Bohr resolvió el problema de la estructura atómica.
El razonamiento de Bohr fue bastante lógico: primero había que obligar al electrón a que se mantuviera en ciertas órbitas permitidas (estables). Es decir, dado que obviamente los átomos en general son estables, los electrones no pueden caer al núcleo. Como el mismo Bohr escribió, se necesitaba una hipótesis extra, una hipótesis que no podía partir ni de la mecánica clásica ni la electrodinámica.
Vamos a suponer, como hizo Niels en 1912, que en un átomo de hidrógeno tenemos un electrón girando alrededor del núcleo en una órbita circular de radio \(r\) con velocidad \(v\).
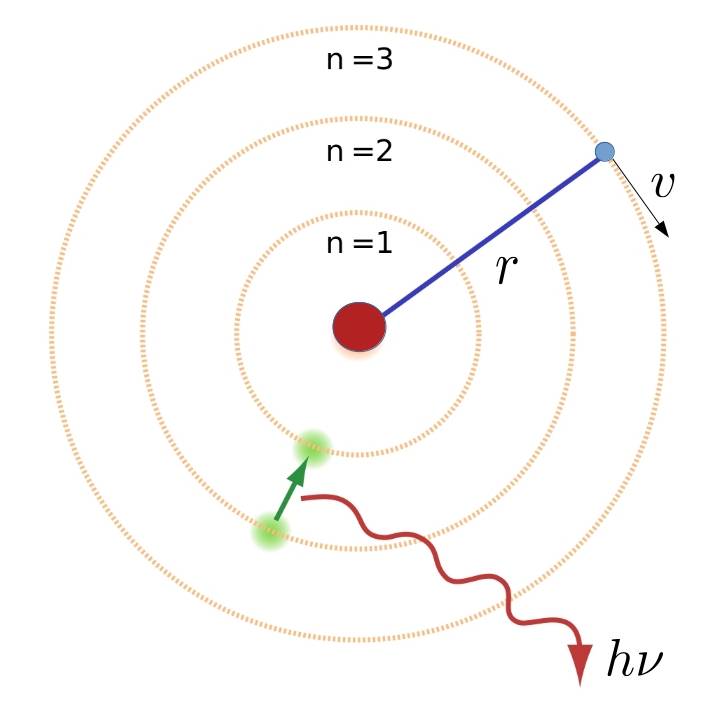
Entonces, ha de cumplirse la segunda ley de Newton, es decir, la fuerza de atracción entre el electrón y el núcleo ha de ser igual a la masa por la aceleración centrípeta (\(v^2/r\)):
$$
m \frac{v^2}r=\frac{k_e e^2}{r^2},
$$
donde \(k_e\) es la constante de interacción electrostatica de Coulomb y \(e\) la carga del electrón. Además la energía del electrón en dicha órbita estable debe conservarse y ser igual a la suma de la energía cinética más la potencial
$$
E=\frac12 mv^2-\frac{k_e e^2}{r}.
$$
Hay dos formas de continuar el razonamiento de Bohr, por lo que elegiremos la más sencilla, es decir, la hipótesis de Nicholson. La suposición extra de Bohr era que de todas las infinitas órbitas posibles sólo son posibles aquellas para las cuales el momento angular del electrón \(L=mvr_n\), siendo \(m\) la masa del electrón, \(v\) su velocidad y \(r_n\) el radio de la \(n\)-ésima órbita estable, fuese múltiplo entero de \(\hbar\), i.e. \(mr_nv=n\hbar\), donde \(\hbar\) es la constante de Planck. Despejando el valor de la velocidad \(v\) y sustituyéndola en la segunda ley de Newton se obtiene el radio de las órbitas estables:
$$
r_n=\frac{\hbar^2 n^2}{m k_e e^2}.
$$
Sustituyendo los valores de las constantes se obtiene el valor \(5.3\cdot 10^{-11}\) metros, lo que se corresponde con los resultados de distintos experimentos de la época. De lo anterior se deduce que la energía \(E_n\) de la \(n\)-ésima órbita es
$$
E_n=\frac12mv^2-\frac{k_e e^2}r=-\frac{k_e e^2}{2r}= -\frac{mk^2_e e^4}{2\hbar^2}\frac{1}{n^2}.
$$
Pero Bohr no se quedó ahí y postuló que los electrones solo podían estar en alguno de dichos niveles permitidos y por tanto las lineas espectrales del átomo de hidrógeno se correspondían a los saltos cuánticos entre dichos estados. Así, si el electrón se encontraba en la órbita \(n\)-ésima y saltaba, al ser excitado, a una nueva órbita \(m\)-ésima con \(m>n\), entonces el átomo absorbía un fotón (radiación de absorción) cuya frecuencia \(\nu\) habría de calcularse por la fórmula \(h\nu =\Delta E=E_m-E_n\), es decir
$$
\nu=\frac{E_m-E_n} h =\frac{mk_e^2e^4}{4\pi \hbar^3} \left(\frac1{n^2}-\frac1{m^2}\right),\qquad n<m=1,2,3,\dots\,,
$$
o, si lo escribimos en términos de la longitud de ondas, por
$$
\frac{1}\lambda=\frac{mk_e^2e^4}{4\pi c \hbar^3} \left(\frac1{n^2}-\frac1{m^2}\right),\qquad n<m=1,2,3,\dots\,,
$$
En otras palabras, los electrones sólo podían estar en ciertas órbitas y al saltar de unas a otras se liberaba o absorbía un fotón cuya frecuencia (o longitud de onda) venía dada por una de las dos fórmulas anteriores. Si comparamos la última fórmula con la de Rydberg (o, si se prefiere, con la de Balmer), se tiene que
$$
R_H=\frac{mk_e^2e^4}{4\pi c \hbar^3}\approx 1.09\times 10^7 \,\mbox{metros}^{-1},
$$
en perfecta concordancia con los resultados espectrográficos previos.
Es decir, la hipótesis cuántica y el ya famoso cuanto de acción de Planck no solo jugaba un papel fundamental en la estabilidad atómica sino también en la explicación del espectro de emisión y absorción del hidrógeno. Cada vez todo apuntaba a que dicha hipótesis y en particular la constante, \(h\) (o \(\hbar\)), no era un mero artificio teórico, \(h\) tenía que ser una de las constantes más importantes de la naturaleza. Todo esto lo publicó Bohr en un artículo aparecido en en el número 121 del volumen 26 del Philosophical Magazine publicado en julio de 1913 titulado «On the Constitution of Atoms and Molecules» que luego completó con otros dos más para tratar el caso de otros átomos y moléculas.
Usando un razonamiento físico Bohr también concluyó que, si en cualquier átomo un único electrón estaba lo suficientemente alejado del núcleo, es decir, si estaba en una órbita muy lejana (\(n\) muy grande), entonces era esperable que la fórmula para las transiciones electrónicas fuese muy parecida a la del hidrógeno, de donde dedujo que la constante en la fórmula de de Rygberg \(K\) tenía que coincidir con el valor \(R_H\) obtenido por él. Este razonamiento constituyó el núcleo de toda una filosofía a la hora de tratar con los sistemas cuánticos y que hoy conocemos como el Principio de correspondencia (de Bohr), que venía a decir que, en algún límite y de alguna forma, la teoría cuántica debía contener a la clásica. En el ejemplo que nos ocupa, esto ocurre si tomamos \(n\) (denominado número cuántico principal) muy grande, entonces prácticamente las frecuencias de emisión clásicas y cuánticas coinciden. Bohr fue un maestro explicando cómo usar el Principio de correspondencia en una serie de trabajos de 1918 con el objetivo de explicar la intensidad de las líneas espectrales de emisión. Este principio fue clave a la hora de descubrir la teoría hoy aceptada que rige el mundo cuántico: la mecánica cuántica, y lo hizo años después, en 1925, un entonces desconocido físico alemán llamando Werner Heisenberg.
Años más tarde, entre 1915 y 1916, el afamado físico Arnold Sommerfeld mejoraría mucho el modelo atómico inicial de Bohr incluyendo órbitas elípticas, los efectos relativistas e introduciendo un principio cuántico más general que el usado por Bohr y que ya había usado Planck en sus trabajos lo que le permitió explicar muchos más fenómenos atómicos, algunos realmente difíciles como el de la estructura fina. Gracias a los trabajos de Sommerfeld el modelo de Bohr comenzó a ser apreciado por el resto de la comunidad científica, en particular por Einstein, quien, según cuenta otro físico amigo de Bohr (Hevesy), al enterarse en 1913 de que el modelo de Bohr era capaz de explicar tanto el espectro de hidrógeno como el del helio ionizado dijo: Este es un gran logro. La teoría de Bohr debe ser entonces correcta.
No obstante del enorme éxito del modelo de Bohr-Sommerfeld, este continuaba siendo muy incompleto y tenía demasiados interrogantes. Por ejemplo, ¿de dónde salía ese extraño postulado sobre las órbitas? ¿Qué significado físico tenía? El mismo Rutherford tras leer el manuscrito de Bohr se lo hacía saber en una carta fechada el 20 de marzo de 1913:
Encuentro una gran dificultad en su hipótesis, de la cual no dudo que se ha dado cuenta plenamente, a saber, ¿cómo decide un electrón a qué frecuencia va a vibrar cuando pasa de un estado estacionario al otro? Me parece que hay que suponer que el electrón sabe de antemano a dónde irá a parar.
De más está decir que el problema era altamente no trivial y que la respuesta completa al mismo tardó en llegar más de 10 años, siendo el primer paso en la resolución del mismo la hipótesis de Louis de Broglie de 1924, que ya comentamos en una entrada anterior. De Broglie postuló que toda partícula se comportaba como una onda cuya longitud de onda \(\lambda\) estaba relacionada con el momento lineal \(p=mv\) mediante la expresión
$$
pv=\frac{h}{\lambda}\quad \Rightarrow\quad pv \lambda= h,
$$
que, comparándola con la condición de cuantización de Bohr \(mvr=n \hbar\), nos conduce a la siguiente relación
$$
\frac{2\pi r}{\lambda}=n,\quad n=1,2,3,\dots\, .
$$
Es decir, las órbitas del átomo de Bohr correspondían a las ondas estacionarias asociadas a los electrones, es decir, era una analogía completa de las ondas estacionarias sobre un anillo (círculo): ¡los electrones eran como las cuerdas de una guitarra!

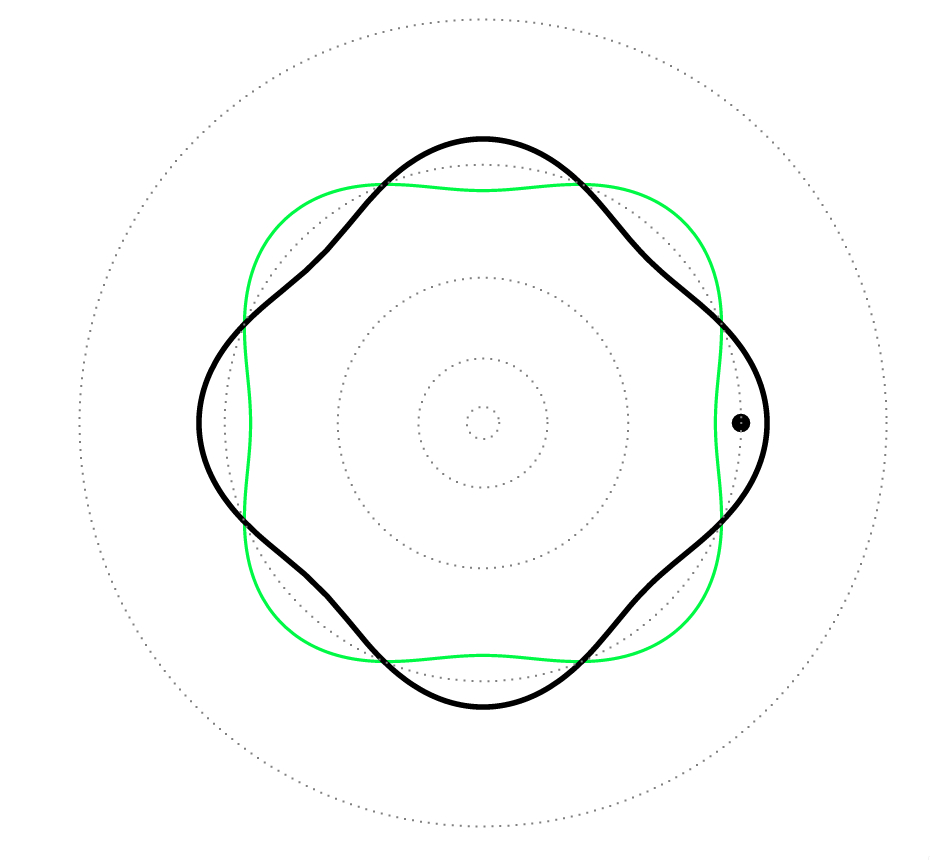
Fig. 7: Ondas estacionarias en una guitarra (arriba) y en una de las órbitas estables (\(n=4\)) del átomo de Bohr (abajo).
A modo de conclusión
Hemos visto que un punto clave para la aceptación del modelo de Bohr por toda la comunicad científica fue la explicación de los espectros de los distintos elementos químicos. De hecho, la importancia del análisis espectral para entender el mundo de lo infinitamente pequeño quedó perfectamente reflejada en el prefacio del influyente tratado de Sommerfeld Atombau und Spektrallinien de 1919, varios años antes de que de Broglie levantara el gran velo. Escribía Sommerfeld:
Lo que en el momento presente estamos escuchando del lenguaje de los espectros es una verdadera música de las esferas dentro del átomo, coros de relaciones integrales, un orden y armonías que cada vez se hace más perfecto a pesar de su plural diversidad. La teoría de las líneas espectrales llevará para siempre el nombre de Bohr. Pero otro nombre permanecerá permanentemente asociado a ella, el de Planck. Todas las leyes integrales de las líneas espectrales y de la teoría atómica surgen de la teoría cuántica. Es el misterioso organon en el que la naturaleza toca su música de los espectros, y cuyo ritmo regula la estructura de los átomos y núcleos.
Pero esa armonía no se pudo apreciar del todo hasta la aparición de una nueva teoría física, una teoría que fue capaz de explicar en su totalidad el funcionamiento de los átomos. Una nueva mecánica que iba a cambiar el mundo en todos los sentidos: la mecánica cuántica. Pero eso, amigo lector, lo contaremos en otra ocasión.
Para saber más
[1] J. Mehra y H. Rechenberg, The Historical Development of Quantum Theory, Vol 1. The Quantum Theory of Planck, Einstein, Bohr and Sommerfeld: Its Foundation and the Rise of Its Difficulties 1900-1925, Springer-Verlag New York Inc. 1982.
[2] José Manuel Sánchez Ron, Historia de la física cuántica: I. El período fundacional (1860-1926), Drakontos, 2001.
[3] Abraham Pais, Niels Bohr’s Times: In physics, philosophy, and polity, Clarendon Press/Oxford University Press, 1991)

Dejar una contestacion